

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Цикл Кребса включает 8 реакций.
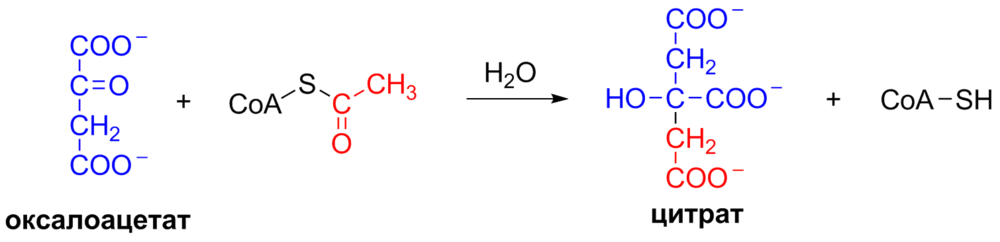
1. Образование цитрата. Углеродный атом метильной группы ацетил-КоА связывается с карбонильной группой оксалоацетата, одновременно расщепляется тиоэфирная связь и освобождается коэнзим А. Катализирует реакцию цитратсинтаза, фермент, локализованный в матриксе митохондрий
2. 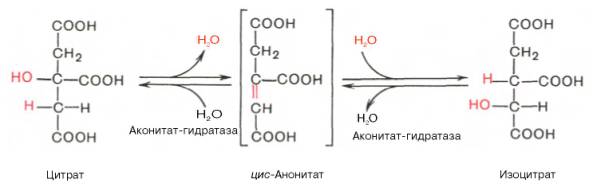
 Превращение цитрата в изоцитрат. Фермент, катализирующий реакцию назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции.
Превращение цитрата в изоцитрат. Фермент, катализирующий реакцию назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции.
3. 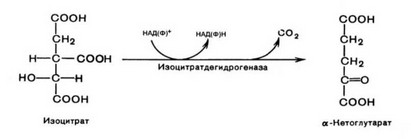 Окислительное декарбоксилирование изоцитрата. Эту реакцию катализирует изоцитратдегидрогеназа.
Окислительное декарбоксилирование изоцитрата. Эту реакцию катализирует изоцитратдегидрогеназа.
4. Окислительное декарбоксилирование α-кетоглутарата
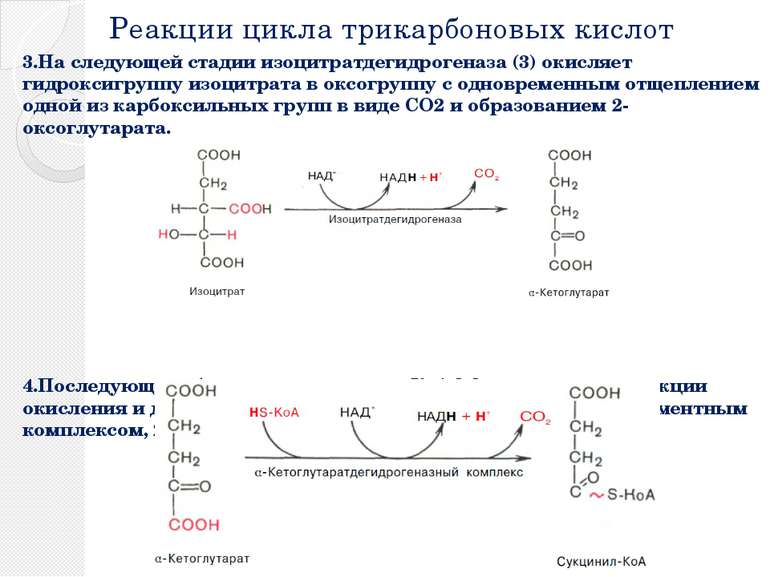
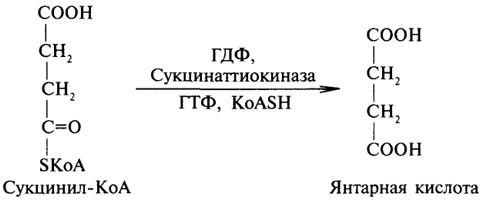
5. Превращение сукцинил-КоА в сукцинат
6. 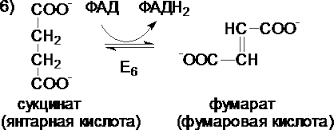 Дегидрирование сукцината. Образовавшийся на предыдущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент- флавопротеин, молекула которого содержит прочно связанный кофермент FAD
Дегидрирование сукцината. Образовавшийся на предыдущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент- флавопротеин, молекула которого содержит прочно связанный кофермент FAD
Пс Е6 означает шестая реакция
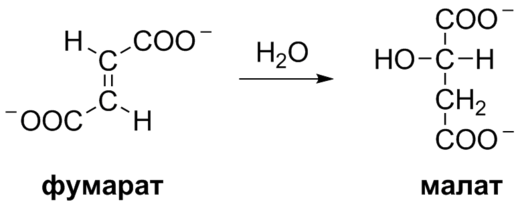
7. Образование малата из фумарата. Образование малата происходит при участи фермента фумаратгидратазы. Этот фермент известен как фумараза.
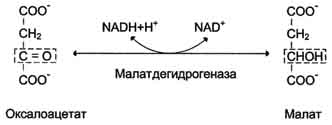
8. Дегидрирование малата. В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоацетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий
Общий путь катаболизма выполняет и анаболические функции. Пируват, а-кетоглутарат и оксалоацетат являются кетоаналогами соответственно аланина, глутаминовой кислоты и аспарагиновой кислоты и путем трансаминирования могут превращаться в эти аминокислоты. Ацетил-КоА служит предшественником жирных кислот. Сукцинил-КоА используется для синтеза гема.
|
|
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза. Фермент построен из четырех субъединиц, каждая из которых содержит прочно связанный ион Мп2+ и витамин биотин, выполняющий коферментную функцию. Биотин соединен с ферментом амидной связью через е-аминогруппу остатка лизина.В ходе реакции С02 вначале присоединяется к биотину (получается карбоксибиотин), затем переносится на пируват.
Другие анаплеротические реакции связаны с образованием пропионил-КоА из валина, изолейцина и жирных кислот с нечетным числом углеродных атомов; пропионил-КоА затем превращается в сукцинил-КоА.
Анаплеротические реакции повышают концентрацию субстратов ЦТК, образуя их в других метаболических путях.
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!