

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Уравнение Клаузиса-Клапейрона можно использовать для расчёта энтальпии испарения, а также при изучении фазовых переходов, например, плавление твердого вещества или испарение жидкости.

График зависимости логарифма давления пара от обратной температуры будет линейным с наклоном  2,303R, из которого могут быть определены значения энтальпии испарения.
2,303R, из которого могут быть определены значения энтальпии испарения.
согласно уравнению Клаузиуса – Клапейрона, увеличение давления приводит к повышению температуры плавления (КРОМЕ ВОДЫ – ПЛОТНОСТЬ ЛЬДА)
Понижение давления пара вследствие добавления нелетучего раствора к растворителю может быть определено с помощью закона Рауля. Так как растворенное вещество является нелетучим, давление пара над разбавленным раствором P, соответствует давлению пара растворителя и может быть приравнено р1, парциальному давлению растворителя. По закону Рауля мы имеем уравнение:

где x2 – это мольная доля добавленного растворенного вещества. Преобразовав формулу, получаем:
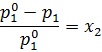
Значит, относительное понижение давления пара над раствором равно мольной доле растворенного вещества.
Прямым следствием из понижения давления пара растворителя над раствором является то, что температура, при которой давление пара раствора достигает атмосферного давления (то есть, точка кипения) должна быть выше, чем температура чистого растворителя.
Уравнение повышения температуры кипения может быть легко получено из уравнения Клапейрона-Клаузиуса  .
.
Это уравнение позволяет рассчитать увеличение температуры кипения раствора, ΔTb:

где m– моляльная концентрация растворенного вещества, Kb- моляльная константа повышения температуры, которая для воды имеет значение 0.511 Kmol-1kg. P – давление пара раствора при температуре T0, p0 – давление пара растворителя при температуре T.
(справедливо при условии, что величина повышения температуры маленькая; разбавленный раствор)
|
|
Другое следствие из понижения давления пара: температура замерзания раствора ниже, чем температура замерзания чистого растворителя. Температура замерзания раствора – это температура, при которой раствор находится в равновесии с растворителем в твердой фазе. При таком равновесии, растворитель должен иметь одинаковое давление пара и в жидкой, и в твердой фазах. Следовательно, температура замерзания - это температура, при которой кривые давления пара растворителя и раствора пересекаются с кривой испарения твердого растворителя;

где Kf –моляльная константа температуры замерзания, которая для воды имеет значение 1.86 Kmol-1kg. 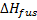 – моляльная теплота плавления
– моляльная теплота плавления
2. Газы и летучие соединения. Растворимость газов в жидкостях. Влияние температуры на растворимость. Влияние давления на растворимость. Растворимость летучих анестетиков в масле.
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!