Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией с водородной деполяризацией.
С водородной деполяризацией корродируют металлы в растворах кислот, например, стальные железнодорожные цистерны, металлические резервуары и аппараты на химических заводах, металлическое оборудование травильных отделений прокатных цехов и цехов гальванических покрытий, в которых осуществляется кислотное травление окалины и ржавчины.
Электрохимическая коррозия с водородной деполяризацией возможна в растворах при наличии ионов водорода:
а) в виде Н+ (раствор неокислительных кислот);
б) в виде НОН (раствор нейтральных солей).
Тип катодного процесса зависит от характера среды раствора электролита:
в кислой среде, при pH < 7, 2Н+ + 2ē = Н2;
в нейтральной и щелочной, pH ≥ 7, 2НOH + 2ē = Н20 + 2ОН-.
Процесс термодинамически возможен в тех случаях, когда равновесный потенциал металла отрицательнее водородного в данных условиях.
Представим схему работы короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите при наличии ионов водорода (рис. 10.4).
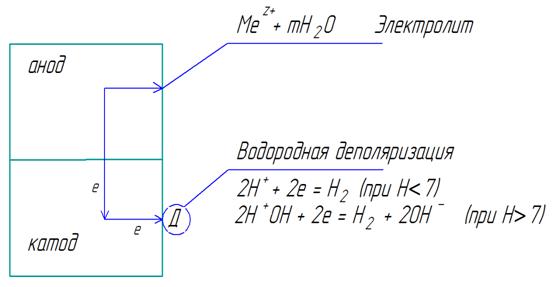
Рис. 10.4. схема электрохимической коррозии с водородной деполяризацией
Приведенную выше схему рассмотрим на примере коррозии изделия из цинка, находящегося в контакте с медью в растворе электролита pH < 7.
1. Поместим цинковую пластину в раствор соляной кислоты (HCl(разб)). Цинк – восстановитель. Взаимодействие идет по реакции:
Zn0 + 2HCl = ZnCl2 + Н2↑
Zn0 = Zn2++ 2ē 
 = - 0,76 В,
= - 0,76 В,
2Н+ + 2ē = Н2. φ0 H+ / H = - 0,059 pH.
Поскольку φ0ок > φ0вос, следовательно, ∆ G 0 < 0; с цинковой пластины наблюдаем выделение водорода.
2. Помещаем в этот раствор медную пластину, не касаясь цинковой. Реакция с медью должна проходить по уравнению:
Cu0 + 2HCl = CuCl2 + Н2↑
Cu0 = Cu2++ 2ē 
 = + 0,34 В,
= + 0,34 В,
2Н+ + 2ē = Н2. φ0 H+ / H = - 0,059 pH.
Установив, что j0 ок < j0 вос, следовательно, ∆G0 > 0, делаем вывод – реакция термодинамически невозможна, водород с медной пластины не выделяется.
3. Коснемся медной пластиной цинковой, начинает работать коррозионный гальванический элемент и наблюдается интенсивное выделение водорода с медной пластины.
После контакта металлов цинк, как элемент с более отрицательным потенциалом, отдает электроны, т.е. окисляется: А: Zn0 - 2ē = Zn2+. Ионы металла, образовавшиеся в процессе окисления, переходят в электролит. Электроны, освободившиеся при этом, могут перемещаться к катодному участку (в данном примере Cu), что на рисунке 10.4 показано стрелками. Процесс коррозии будет длиться до тех пор, пока электроны будут удаляться с катодного участка. В противном случае начинается поляризация металлов, то есть отклонение потенциала цинка в более положительную сторону, а меди – в более отрицательную. Разность потенциалов уменьшается, коррозия замедляется, вплоть до прекращения. Однако медь – металл, и является лишь проводником электронов. Ионы водорода подходят к меди, снимают избыток электронов К: 2Н+ + 2ē = Н2, и потенциал меди становится более положительным, то есть разность потенциалов увеличивается – коррозия ускоряется.
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. Таким образом, ионы водорода играют роль деполяризатора.
Чтобы рассмотреть кинетику процесса, необходимо учесть перенапряжение разрядки водорода на том или ином металле. Так как величина перенапряжения восстановления водорода на цинке больше ( (Zn) = 0,83), чем на меди
(Zn) = 0,83), чем на меди  (Cu) = 0,64, то водород на меди разряжается быстрее, чем на цинке, поэтому на меди мы видим более интенсивное выделение водорода.
(Cu) = 0,64, то водород на меди разряжается быстрее, чем на цинке, поэтому на меди мы видим более интенсивное выделение водорода.
термодинамическая вероятность процесса рассчитывается по формуле: Δ G ′ = – zFE ′ = – zF [(φ0ок – hок) – (φ0вос + hвос)].
Значение перенапряжения может оказать существенное влияние на значение ∆ G 0, вплоть до изменения знака на обратный.





 = - 0,76 В,
= - 0,76 В, (Zn) = 0,83), чем на меди
(Zn) = 0,83), чем на меди 


