Цель работы: Определение молярной массы эквивалента металла полумикрометодом.
Метод основан на измерении объема водорода, который выделяется при действии разбавленных растворов кислот на металл.
Для этой цели удобно использовать установку, состоящую из бюретки, укрепленной на штативе; воронки, соединенной с бюреткой резиновой трубкой. Бюретка и воронка наполовину заполнены подкрашенной водой и представляют собой сообщающиеся сосуды. К бюретке присоединяется пробирка, в которую налита разбавленная кислота (рис. 16).
Гарантия успешного проведения опыта – герметичность прибора. Для проверки установки на герметичность следует подсоединить пустую пробирку к бюретке, проверить, плотно ли притерты пробки. Затем поднять воронку на 15 -20 см и наблюдать за изменением уровня жидкости в бюретке. Если уровень изменяется не более чем на 0,5 – 0,7 мл, значит, прибор герметичен, и можно приступать к работе.
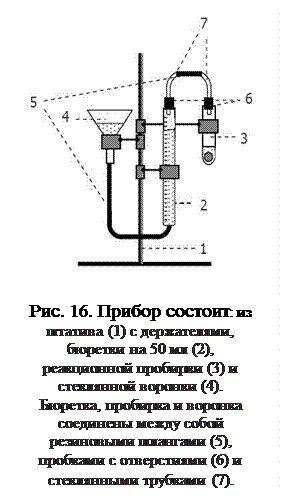 Объем водорода определяют по разности уровней воды в бюретке до и после опыта. Перед проведением реакции необходимо снять пробирку и установить воронку так, чтобы уровень жидкости в бюретке установился точно на нулевом делении (отсчет проводится по нижнему мениску).
Объем водорода определяют по разности уровней воды в бюретке до и после опыта. Перед проведением реакции необходимо снять пробирку и установить воронку так, чтобы уровень жидкости в бюретке установился точно на нулевом делении (отсчет проводится по нижнему мениску).
Определение молярной массы эквивалента металлов основано на следующей реакции:
Mе + H2SO4 = MеSO4 + H2
Реакцию проводят следующим образом. Пробирку заполняют примерно на одну третью часть кислотой. Наполнив пробирку, положить в нее навеску металла так, чтобы она не касалась кислоты.
Присоединить пробирку к бюретке и слегка потрясти, чтобы навеска металла упала в раствор. Наблюдать выделение водорода и вытеснение воды из бюретки.
По окончании реакции, т.е. когда весь металл растворится, дать пробирке остыть, привести жидкость в бюретке и воронке к одному уровню и точно отметить уровень воды в бюретке.
Учитывая давление водяных паров при комнатной температуре, привести объем выделившегося водорода к нормальным условиям, исходя из соотношения:
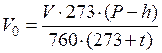 ,
,
где V 0 – объем выделившегося водорода, приведенный к нормальным условиям, мл;
V – объем, выделившегося водорода в условиях опыта, мл;
P – атмосферное давление, определенное по барометру, мм. рт. ст.;
h – давление насыщенного водяного пара, соответствующее температуре опыта, мм. рт. ст.;
t – температура опыта, оС.
Экспериментальная молекулярная масса эквивалента металла вычисляется по закону эквивалентов для случая, когда одно из реагирующих веществ является газом.
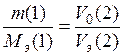 ,
,
где m (1) – навеска металла, задается преподавателем, г;
V 0(2) – объем выделившегося водорода, приведенный к нормальным условиям, мл;
Vэ (2) – объем эквивалента водорода (11200 мл);
Мэ (1) – молярная масса эквивалента металла, г/моль;
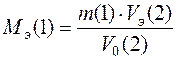 .
.
Теоретическую молярную массу эквивалента соответствующего металла рассчитать по формуле
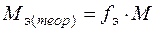 ,
,
где fэ – фактор эквивалентности данного металла
(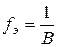 , В - валентность), М – молярная масса металла.
, В - валентность), М – молярная масса металла.
Рассчитать ошибки:
1) абсолютная ошибка 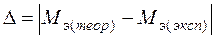 ;
;
2) относительная ошибка 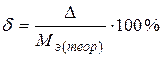 .
.
Записать уравнение реакции взаимодействия металла с кислотой или щелочью, зарисовать прибор, сделать выводы.
Контрольные вопросы
1. Как определяется фактор эквивалентности простого вещества и химического соединения?
2. От чего зависит величина фактора эквивалентности и молярной масса эквивалента кислоты и гидроксида в реакции?
3. Вычислить фактор эквивалентности двухосновной кислоты, если известно, что 2 г ее содержат 0,1 г водорода, способного замещаться катионами металла.
4. Рассчитать объем эквивалента кислорода.
5. Почему после опыта жидкость в бюретке и воронке приводится к одному уровню?
6. Чему равен фактор эквивалентности окислителя и восстановителя в окислительно-восстановительной реакции?
Лабораторная работа № 3



 Объем водорода определяют по разности уровней воды в бюретке до и после опыта. Перед проведением реакции необходимо снять пробирку и установить воронку так, чтобы уровень жидкости в бюретке установился точно на нулевом делении (отсчет проводится по нижнему мениску).
Объем водорода определяют по разности уровней воды в бюретке до и после опыта. Перед проведением реакции необходимо снять пробирку и установить воронку так, чтобы уровень жидкости в бюретке установился точно на нулевом делении (отсчет проводится по нижнему мениску).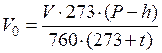 ,
,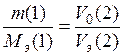 ,
,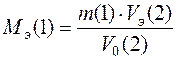 .
.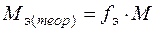 ,
,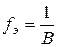 , В - валентность), М – молярная масса металла.
, В - валентность), М – молярная масса металла.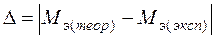 ;
;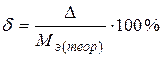 .
.


