Химическая связь удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, водородную.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. 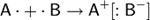
Ковалентная связь — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой.Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Неполярная ковалентная связь образуется между двумя одинаковыми атомами (О2, N2, Cl2). Ковалентная полярная связь образуется между двумя различными неметаллами. 2 механизма образования ков-ой связи: 1) по обменному механизму взаимодействует 1 неспаренный электрон от каждого атома. Образуется общая электронная пара. 2) По донорно акцепторному механизму связь образована между неподеленной электронной парой одного атома и свободной орбиталью другого атома. Атом с парой – донор, ион с орбиталью – акцептор.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H. Водородная связь явл-ся непрочной и распространенной в природе.
Метод молекулярных орбиталей. Строение молекулы водорода с позиции теории молекулярных орбиталей.
Метод молекулярных орбиталей используется в квантовой механике для описания химических связей в соединениях.В его основе несколько принципов:
1)В молекуле все электроны находятся в поле действия их ядер, одако реально учитывается взаимодействие только внешних электронов.
2)Атомная орбиталь представляет собой волновую функцию электрона в поле действия одного центра ядра атома.
3)Число молекулярных орбиталей всегда должно быть равно числу атомных орбиталей, взятых, для их построения. Электроны заполняют орбитали согласно принципу Паули, правила Хунда и принципа минимизации энергии
Для построении молекулярной орбитали молекулы водорода нужно взять две атомные орбитали: по 1 S-орбитали от каждого атома: 1)сложение волн, которое происходит, когда фаза волновой функции совпадает.  2)Вычитание волн происходит, когда волновые функции находятся в противофазе.
2)Вычитание волн происходит, когда волновые функции находятся в противофазе. 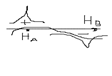 Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.
Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.



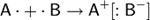
 2)Вычитание волн происходит, когда волновые функции находятся в противофазе.
2)Вычитание волн происходит, когда волновые функции находятся в противофазе.  Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.
Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.


